Humor
Egzamin poprawkowy Chemia II sem. 16.09.2016
Scharakteryzuj kwas węglowy i tworzone przez niego sole.
- Jest on stosowany do usuwania twardości wody.
- Elementarny węgiel występuje w dwóch odmianach metalicznych: fullereny, diament i w jednej odmianie półmetalicznej: grafit. Nie występuje w środowisku naturalnym. Słabo reaguje w obecności z wodą.
- Kwas węglowy jest kwasem organicznym, stosunkowo słabym i nietrwałym. Otrzymuje się go w procesie syntezy wody i dwutlenku węgla. Kwas węglowy tworzy sole: węglowodory i węglany sodu. Węglowodory zawierają jon ...
- - kwas węglowy jest mocnym kwasem tlenowym. Wraz ze wzrostem l. atomowej węgla moc kwasu rośnie. Sole kwasu węglowego tworzą węglany.
Podaj charakterystykę 15 grupy układu okresowego.
- Wśród ciał stałych znajduje się gaz.
- Tworzą kwasowe wodorki o charakterze zasadowym.
- Występują w stanie wolnym (As) i związanym ().
Czym jest mieszanina nitrująca i na czym polega jej działanie?
- Mieszanina nitrująca = . Nitrowanie pierścieni alkalicznych.
- Mieszanina nitrująca jest to mieszanina i , używana w chemii organicznej do nitrowania, uzyskiwania estrów. rozpada się i dołącza się w miejscu .
Egzamin poprawkowy Chemia II sem. 18.09.2014
Fluorowodór rozpuszczony w wodzie jest znacznie słabiej zdysocjowany od chlorowodoru rozpuszczonego w wodzie. Co jest tego przyczyną?
HF jest dużo słabszym kwasem (ogólnie to słaby kwas) niż HCl, a związki słabe są słabiej zdysocjowane, słabiej dysocjują. Przyczyną jest więc różna moc tych kwasów.
Podkreśl związek będący kwasem Lewisa i uzasadnij swój wybór: .
Kwas Lewisa - związek zdolny do przyjęcia protonu (ma wolną parę elektronową). może zostać zredukowany do przez przyłączenie dwóch jonów .
Wejściówka przed laboratorium Chemia III sem. 17.11.2011
Jony kobaltu wykrywamy:
- przy pomocy alkoholu izoamylowego.
- bizmutanem sodu i alkoholem izoamylowym.
- po zielonej barwie roztworu.
- po dodaniu rodanku amonu i alkoholu izoamylowego do roztworu powstaje malinowa górna warstwa.
- po dodaniu wytrąci się fioletowy , który brunatnieje.
- roztwarzamy w i dodajemy dimetyloglioksym, powstaje niebieskie zabarwienie.
Ciekawe stwierdzenia:
- Jony wykrywamy w reakcji obrączkowej.
- Jony należy podgrzać – zaobserwujemy bąbelki.
- W otrzymanym wyciągu sodowym wykrywamy jony węglanowe w reakcji z .
- Jony utleniają jony do .
Egzamin Biotechnologia II sem. 21.10.2011
Co to są związki kompleksowe?
- Są to związki składające się z przynajmniej z atomów centralnych.
- To związki metalu z wodorotlenkiem.
Kwas ortoborowy jest kwasem bardzo słabym gdyż:
- jest słabo elektroujemny.
- bor ma niską elektroujemność.
- podczas dysocjacji przyjmuje elektron.
- bardzo łatwo ulega dysocjacji.
Inne ciekawostki:
- to siarczan(VI) amoniaku miedzi(II).
- Kwas ortoborowy: .
- Pierwiastki bloku d mają właściwości utleniające.
Egzamin Biotechnologia 1 rok 15.09.2011
Jaki wzór ma kwas krzemowy, co jest składnikiem szkieletu okrzemek?
Składnikiem szkieleta jest ; kwas okrzemkowy: .
Twardość przemijająca powodowana jest przez węglowodory wapnia.
Jon rodankowy ma geometrię:
- płaską liniową
- oktaedryczną
Nowe wzory... ozon i kwas fosforowy(III):
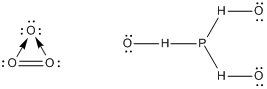
Dysocjacja kwasu borowego:
B(OH)4+ + OH-') ?>
Który związek – czy ma niższą temperaturę wrzenia? Uzasadnij odpowiedź.
- ma wyższą temperaturę wrzenia, ponieważ w przeciwieństwie do nie tworzy wiązań wodorowych.
- gdyż występują w nim wiązania wodorowe, które są kruchliwe (słabo połączone) w wyniku czego szybciej wrze.
Egzamin Chemia II sem. 16.09.2011
Kwas azotowodorowy ma zastosowanie:
- w przemyśle spożywczym
- do produkcji nawozów
- jako składnik proszków do pieczenia
- w dezynfekcji pomieszczeń dlka zwierząt
Ciekawe nazwy i wzory chemiczne:
- – cyny sodu wodorotlenek
- – heksaredoksocynian sodu
Ciekawe stwierdzenia:
- Tlenowce tworzą z wodorem związki typu .
- Azot występuje w postaci cząsteczek dwuatomowych, a fosfor, arsen, antymon i bizmut w postaci pojedynczych atomów (budowa jednoatomowa).
- Pierwiastki 15 grupy występują w postaci tlenków i wodorków.
- Azot występuje w cząsteczkach trójatomowych.
- W warunkach normalnych azot jest w stanie ciekłym, a reszta pierwiastków gr. 15 to ciała stałe.
- Rodzaje węglików: acetylenki, metylenki i cementylem.
- Węgliki kowalencyjne to karbonylki.
- Najsłabszym kwasem chloru jest . Jego anion wykazuje geometrię analityczną.
- jest bardzo odporny na działanie wody.
- – geometria kontowa.
ma znacznie mniejszy moment dipolowy od . Dlaczego?
- Ponieważ różnica elektroujemności w jest mniejsza niż w .
- Ponieważ fluor w ma znacznie więcej wolnych par elektronowych.
- Gdyż w cząsteczce powstają wiązania wodorowe.
- Ponieważ wiązania N-H nie są ułożone liniowo tak jak 2 wiązania N-F w cząsteczce , w związku z tym moment dipolowy jest sumą 3 wiązań, a tylko jednego.
- Gdyż amoniak ulega asocjacji.
- Przez wiązania wodorowe.
- Związane jest to z większą mocą wiązań w spowodowanych większą elektroujemnością azotu.
- Ponieważ tworzy znacznie mocniejsze wiązania.
- Ze względu na asocjację fluoru.
- Większy moment dipolowy będzie wykazywała cząsteczka , ponieważ występuje większa różnica elektroujemności pomiędzy N i F niż pomiędzy N i H.
- Ponieważ fluor jest o wiele większym atomem niż wodór.
- Ponieważ jest inne wiązanie: – jonowe, – spolaryzowane.
- Cząsteczki amoniaku łączą się ze sobą dlatego ich moment dipolowy jest większy.
- Ponieważ wodór słabiej "trzyma" elektrony, więc są bardziej oddalone od pierwotnych jąder atomowych.
Nowe wzory tlenków azotu:
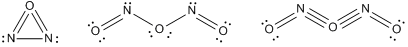
Egzamin Chemia III sem. 08.02.2011
Przykładowe odpowiedzi do zadań:
- , i to utleniacze – mają właściwości redukujące
- K jest silnym reduktorem, ponieważ chętnie przyłącza
- Pt jest silnym reduktorem, bo do jej roztworzenia konieczne jest użycie wody królewskiej (silny utleniacz)
Egzamin Biotechnologia I sem. 27.01.2011
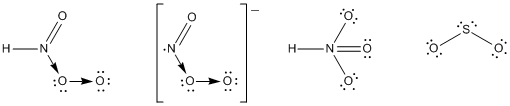
Nowe wzory chemiczne (kwas azotowy(V), azotan(V), kwas azotowy(V), ditlenek siarki):
Chemiczne, laboratoryjne metody otrzymywania:
- tlenu
- proces destylacji powietrza atmosferycznego
- wodoru
- 2 Al[K(OH)4] + H2 \u') ?>
- 2 NH3 + H2 \u') ?>
Główne źródło energii wytwarzanej na Słońcu:
- promieniowanie ultrafioletowe
- zderzenia jąder wodoru
- rozpady jąder wodoru
- wybuchy supernowych
- proces nukleazy
- pochłanianie gwiazd
- utlenianie wodoru
Egzamin poprawkowy Biotechnologia 15.09.2008
Dlaczego wodne roztwory soli glinu mają odczyn kwaśny?
- Ponieważ jon Al w roztworze wodnym tworzy zasadę
- Ponieważ sole Al(III) w wodzie tworzą Al(OH)3 i kwas
- Wodne roztwory soli Al(III), np. Al2(NO3)3 mają odczyn kwaśny, ponieważ reagują z zasadami tworząc wodorotlenek amfoteryczny
Co to jest twarda woda?
- ...twardość wody nieprzemijająca charakteryzuje wodę zawierającą metale ciężkie
- Jest to woda, w której znajduje się zbyt dużo fosforu
Kwas ortoborowy jest kwasem bardzo słabym – dlaczego?
- Dysocjuje bardziej na kształt zasady (t.j. powstaje dużo jonów OH−).
- Ponieważ w roztworach wodnych jest słabo zdysocjowany.
Reakcja przebiegająca w trakcie produkcji HNO3
z N2 jako substratu:
ogółem: HNO3') ?>
albo: NO2 + HNO3') ?>
Z wejściówek przed laboratorium
Klasyczna analiza chemiczna (wg Bunsena) opiera się na podziale kationów na pięć grup. Ołów znajduje się zarówno w I, jak i w II grupie kationów – proszę wyjaśnić dlaczego.
- Ołów zaliczany jest zarówno do I jak i do II grupy kationów, ponieważ częściowo rozpuszcza się w odczynniku grupy I, a częściowo w odczynniku grupy II.
- Ołów jest na dwóch stopniach utlenienia i reaguje nie tylko z kwasami, jak w przypadku grupy II.
- Ołów tworzy jony Pb+ i Pb2+. Jony Pb+ dają się wykryć tylko w I grupie kationów, natomiast Pb2+ tylko w II grupie kationów.
- Ołów w niektórych przypadkach zachowuje się jak kation z grupy II – reaguje z wieloma odczynnikami, z którymi reagują kationy II grupy.
- Ołów I wartościowy jest w I grupie, gdzie odczynnik grupowy to HCl i tworzy trudno rozpuszczalny PbCl, natomiast w II grupie jest to siarkowodór i powstaje trudno rozpuszczalny PbS.
- Ołów ulega reakcjom takim, jak kationy II grupy i daje podobne efekty w reakcjach.
Zimowa sesja egzaminacyjna 2006/07
„Nowe” reakcje chemiczne:
- Na2 + 2 H2O → 2 Na(OH)2 + H2
- 2 Mg2O → 2 Mg2 + O2
- Na2SO4 + CuSO4 + Na2
Korzystając z teorii LCAO oceń, czy może istnieć
jon Ne2+.
Ne2+ nie może istnieć –
cząsteczka ta trzyma się tak samo, co "rozlatuje".
Substancja określana mianem ciężkiej wody to:
- deuter
- H2O2
- HDO
- deuter + O2
- woda deuterowa
- 21D
Wiązania wodorowe można spotkać:
- na wykładach z chemii
- w powietrzu
- w paliwie rakietowym
- w bombach wodorowych
Węgiel występuje w różnych postaciach alotropowych, np. grafit, toluen, diament...
Jon wodorowęglanowy to:
- CH4
- HCO2
- NO3-
- HCOOH
Z letniej sesji egzaminacyjnej 2005/06
Ciekawe definicje:
- woda konstytucyjna – woda oczyszczona, ale jeszcze nie do końca
- woda krystalizacyjna – woda oczyszczona całkowicie i bardzo zdrowa jako pitna
- Liczba Avogadro – jest to ilość drobin zawarta w liczbie moli
Problemy z symbolami pierwiastków:
- siarka – Si
- krzem – K
- potas – P
- fosfor – F
- srebro – Sr
Egzamin z chemii nieorganicznej – Biotechnologia sem. III
- woda konstytucyjna – woda oczyszczona, ale jeszcze nie do końca
- woda krystalizacyjna – woda oczyszczona całkowicie i bardzo zdrowa jako pitna
- Anhydraza węglanowa:
- bierze udział w przyswajaniu alkoholu w naszych organizmach
- enzym niezbędny w magazynowaniu insuliny
- prowadzi on do wiązania azotu
- cynk zawarty w anhydrazie węglanowej utlenia HCOOH do aldehydu mrówkowego
- bierze udział przy rozkładzie tłuszczów
- stymuluje trawienie i metabolizm związków organicznych, uaktywnia odpowiednie zwiazki
- w organizmach żywych enzym ten służy do przeprowadzania szlaków metabolicznych węglanów
- bierze udział w rozkładzie aldehydów
- bierze udział w rozkładzie aldehydu, powstałego w wyniku nadmiernego wypicia alkoholu
- reguluje procesy życiowe
- bierze udział procesach trawiennych
- bierze udział w procesie tworzenia ATP
- Ureaza:
- łączy O2 z atmosfery
- hydrolizuje białka w organizmie człowieka
- katalizuje rozkład mocznika na wodę i dwutlenek węgla
- bierze udział w różnego rodzaju cyklach zachodzących w organizmie
- rozkłada uracyl - zasadę azotowa
- pozwala filtrować związki w nerkach
- ma wpływ na metabolizm organizmów żywych oraz układ immunologiczny
- jest odpowiedzialny za wiązanie mocznika z gleby
- nikiel wiąże mocznik, a więc zapobiega zatruwaniu się organizmu
- rozkłada urobilinogen
- pełni ważna rolę w układzie pokarmowym, trawiennym
- enzym pozwala na produkcję mocznika
- wspomaga przyswajanie i przemianę tłuszczów i węglowodanów
- uraza katalizuje proces wytwarzania mocznika
- Dehydrogenaza alkoholowa:
- bierze udział w reakcjach redukcji alkoholi za pomocą cząsteczki wody
- Pełni on taką rolę, że nie pozwala na proces hydrogenazy. Jest przeciwny do niego.
- Pełni rolę oddechową
- Katalizuje powstanie (jakie? styczniowe? listopadowe?)
- przenoszenie tlenu we krwi
- odpowiedzialny za tworzenie jonów wodorowęglanowych z CO2 i H2O
- przekształca alkohol C2H5OH w C2H4
- to enzym biorący udział w przemianach (metabolizmie) puryn i tłuszczów
- transportuje CO2
- wiąże H2O
- Zamienia formę alkoholu w formę możliwą do transportowania. Odszczepia jon H+.
- Pierwiastki niezbędne do życia i ich rola:
- Kadm
- obecność tego pierwiastka zapobiega tarczycy
- Jod
- pełni rolę w układzie immunologicznym
- składnik witaminy B
- składnik enzymów biorących udział w przemianach białek, lipidów i węglowodanów.
- Kadm
- Woda twarda – woda zła, czyli "złote myśli":
- Trwała twardość wody jest spowodowana tym, że zamiast 12H jest izotop 22D – deuter. D2O – woda twarda.
- Twardą wodę warto zmiękczać, ponieważ osądzający się kamień niszczy urządzenia, powodując między innymi ich rdzewienie.
- Aby usunąć twardość stałą należy wodę chlorować.
- Twardość węglanowa spowodowana jest obecnością soli węglowych, np. siarczanu węgla.
Z egzaminów
- Standardowa elektroda wodorowa zbudowana jest z blaszki wodorowej, zanurzonej...
- Izotopy wodoru:
tryt - W aluminotermii występuje zjawisko surówki. Do zjawiska surówki najczęściej dochodzi w wielkim piecu
- Właściwości metali:
metale są płaskie - Temperatura Ziemii zwiększa się z roku na rok o około 1°C.
- Wodę utlenioną i jodynę stosuje się do odkażania ran, gdyż mają one właściwości promieniujące.
- Jon jest paramagnetyczny ponieważ...
posiada on niesparowaną parę elektronową. - Siarczan żelaza(III) rozpuszczony w wodzie nadaje jej odczyn kwaśny. Dlaczego?
- Gdyż podwyższa stężenie jonów wodorotlenkowych .
- Gdyż kwas siarkowy jest bardzo mocnym reduktorem i jednocześnie jest mocnym kwasem.
- Ozon to gaz, który najczęściej można spotkać w postaci stałej lub cieczy.
- Cząsteczka ma kształt piramidy biagonalnej
- Elektrony rozmieszczamy w kierunku zgodnym z ruchem wskazówek zegara.
- Charakterystyka pierwiastków bloku s:
Niektóre pierwiastki mają dwa jądra. - Masa molowa Co to:
M(Co) = 12 + 8 = 20 g/mol
węgiel = 12 plus 8 ("o" jest małe, więc tylko polowa z 16) - Zjawisko kontrakcji lantanowców polega na łączeniu się atomów w długie łańcuchy
- Hydroliza wody: .
- Silany to Si, Ge, Sn i Pb.
- Rtęć dobrze reaguje na zmiany temperatury.
- Nie można określić, gdzie jest wiązanie zdelokalizowane, bo ono się porusza.
- Elektrony, które posiadają ładunek elektryczny, to jony
- Odmiany alotropowe węgla to:
Tlen singletowy i trypletowy. - Fosfor czarny - odmiana stosowana w nawozach
- Co to jest szkło?
Spalony piasek. - Iloczyn rozpuszczalności jest to możliwość rozpuszczalności związków podczas hydrolizy.
- Dymiący kwas siarkowy to:
nadmiar w - Podaj nazwy i wzory rud zelaza.
Brąz, stal i surówka. - Oleum to:
bezwodnik . - Elektrony rozmieszczamy tak, aby konformacja była najlepsza
- Metody otrzymywania soli.
metal + niemetal → kwas ( HCl') ?>) - Wymień dwa halogenki fosforu:
i - Minerał cynku:
mosiądz - Szkło kwarcowe różni się tym od sodowego, że do produkcji pierwszego używa się krzemu, a do drugiego sodu
- Objętość produktów powinna być stała na podstawie prawa zachowania objętości. W tym przypadku jest jednak mniejsza na skutek zjawiska skurczenia gazów
- Opary karbidu łączą się z tlenem i zapalają się
- Występują tu elektrony niesparowane o jednakowym spidzie
- Dla obniżenia kosztów do brązu dodaje się sodu i potasu
- ...atomy tych związków różnią się od siebie zewnętrzną budową kryształów
- Podaj prawo zachowania masy.
Jeżeli masa gdzieś zniknie, to musi się gdzieś pojawić. - Kto odkrył polon?
Poloniusz - Kwas - związek mogący przyjąć neutrony (neutronobiorca)
- Diament ma strukturę:
- Twardą, ale nieuporządkowaną
- Połączonych sześcioczłonowych rombów
- Karbid to doskonały rozpuszczalnik dla związków organicznych
- Suchy lód to:
- ciekły azot
- ciekły który ulega gwałtownemu rozprężaniu
- Iloczyn jonowy to pH
- Cynk służy do spawania i do oblewania nim innych rzeczy
- Karbid - niedawno odkryty związek węgla
- Bufor utrzymuje małe pH
- Niesparowany elektron na biegunie antywiążącym
- Jednym z minerałów cynku jest cyrkonit
- Energia jonizacji to ilość energii potrzebna by oderwać izolowany atom w stanie gazowym z powłoki walencyjnej
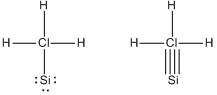
- Nowe wzory chlorosilanu: